臨床研究法の解説文
1)臨床研究法の対象となる医学研究、特定臨床研究とは?
臨床研究のうち,次のいずれかに該当するものです。ただし、治験に該当するものは除きます。
①薬機法(医薬品医療機器等法)において未承認の医薬品・医療機器を用いて行う臨床研究
例)海外でのみ承認されたハンノキ花粉アレルゲンエキスを用いてハンノキ花粉症児に免疫療法を行い, その有効性や安全性を検討する研究。
②薬機法において承認された医薬品・医療機器を用いるが,承認を受けているものと異なる用法・使用
法で用いた臨床研究
例)食物アレルギー児の経口免疫療法で,気管支喘息にのみ適応があるオマリズマブを前投与してから食物アレルゲンを摂取し,その有効性や安全性を検討する研究。
③製薬企業あるいは医療機器企業から資金提供を受けて実施する当該企業の医薬品あるいは医療機器を
用いた臨床研究
例)High Flow Nasal Cannula を入院治療する喘息児に使用し,ネブライザー吸入単独と比較し入院日数
の短縮を検討する研究で,企業から資金を受けるもの
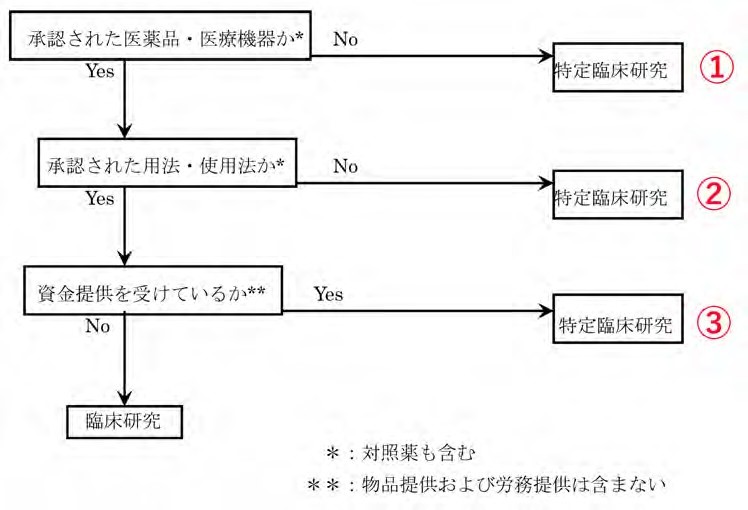
図1 特定臨床研究の判別フロー

図2 臨床研究における規制の区分について
2)臨床研究の実施に関する手続き
A)特定臨床研究実施に関する措置
(1)厚生労働大臣の認定を受けた認定臨床研究審査委員会(注1:認定臨床研究審査委員会)の意見を聴き,意見の内容を記載した書類を添付して,「実施計画」を厚生労働大臣に提出する。
(2)実施計画の遵守,特にモニタリング・監査の実施,利益相反の管理等の実施基準の遵守およびインフォームド・コンセントの取得,個人情報の保護、記録の保存を行う。
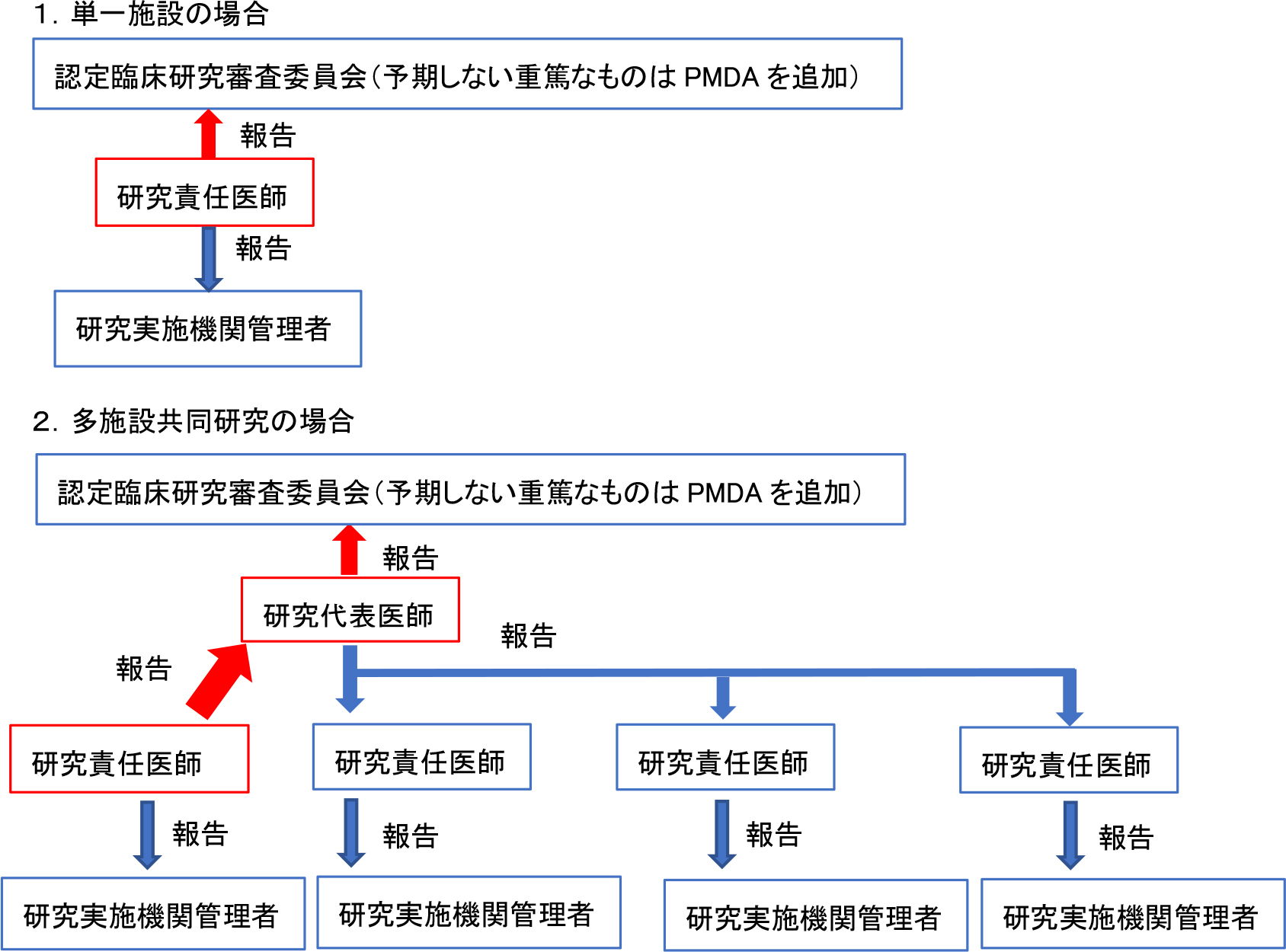
(3)特定臨床研究の実施に起因するものと疑われる疾病,障害,死亡,感染症(疾病等)の発生を認定臨床研究審査委員会に報告し意見を聞き,同意見を添えて厚生労働大臣へ報告する(注2:重篤な有害事象発生時の対応)。
(4) 実施状況について,認定臨床研究審査委員会へ定期的報告,および厚生労働大臣へ定期的報告する。
(5) 厚生労働大臣は実施基準違反に対する指導・監督を行う。
(ア)厚生労働大臣は改善命令を行い、従わない場合には特定臨床研究の停止等を命じることができる。
(イ)厚生労働大臣は保健衛生上の危害の発生・拡大防止のために必要な場合には、改善命令を経ることなく特定臨床研究の停止等を命じることができる。
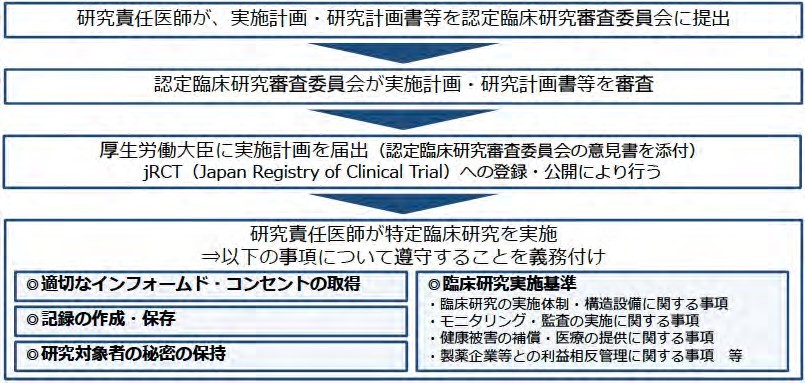
図 3 特定臨床研究を行う際の手順のまとめ
B)製薬企業等が行う手続き
(1) 当該製薬企業等の医薬品等の臨床研究に対して資金を提供する際の契約の締結を義務付け
(2) 当該製薬企業等の医薬品等の臨床研究に関する資金提供の情報等の公表を義務付け
3)臨床研究法制定の背景
臨床研究法は平成 30 年 4 月 1 日に施行された法律で、“臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関する情報の公表の 制度等を定めることにより、臨床研究の対象者をはじめとする国民の臨床研究に対する信頼の確保を図る ことを通じてその実施を推進し、もって保健衛生の向上に寄与することを目的”として制定された。そのき っかけとなった事例として Novartis 社によるディオバンの臨床試験が存在する。
同研究では、ノバルティス社の社員が大阪市立大学の非常勤講師として臨床試験に参加、京都府立医科大学及び東京慈恵医科大学の内部調査ではデータ操作が行われたと公表したが、ノバルティス社は意図的なデータ操作を行った証拠は発見できなかったと発表した。この事案により臨床試験におけるデータ操作による試験結果の信頼性欠如、研究者の利益相反行為の問題が指摘され、社会問題となった。
ディオバン事案の状況把握並びに再発防止策の具体的な方策検討から、“臨床研究に関する倫理指針”の見直し、さらに臨床研究の信頼回復のため法制度の必要性が検討された。“臨床研究に関する倫理指針”の見直しとして、①倫理審査委員会の機能強化と審査の透明性確保のための規定充実、②研究責任者の責務の 明確化、教育・研修の規定充実、③データ改ざん防止のため、モニタリング・監査の規定新設、④資料の保存に関する規定新設、⑤利益相反に関する規定新設、がもりこまれた。また臨床研究に係る精度の在り方 に関する検討会で法規制が必要と結論、平成 29 年 4 月 14 日臨床研究法の公布、平成 30 年 4 月 1 日施行となった。下図に法制度の見直しの考え方について図を示す(https://www.mhlw.go.jp/content/10800000/000460132.pdf から抜粋)
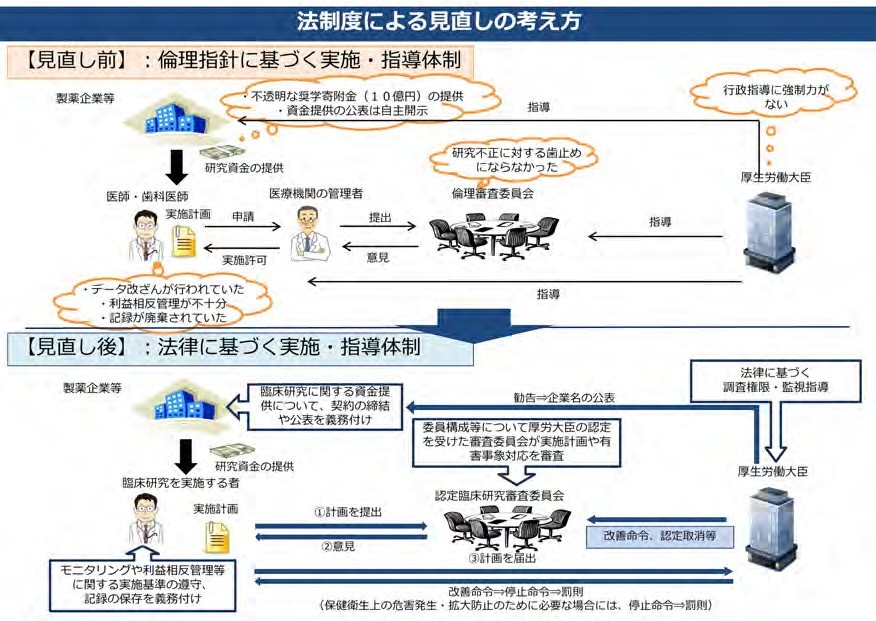
図 4 臨床研究法による臨床研究の見直しの背景
参考資料
https://www.mhlw.go.jp/content/10800000/000460132.pdf
注1:認定臨床研究審査委員会
認定臨床研究審査委員会(CRB:Certified Review Board)とは、委員構成などについて厚生労働大臣の認定を受けた審査委員会で、2019 年 3 月現在、全国の国立大学などに 90 の委員会が認定され、厚生労働省の「臨床研究法」のウエブサイト(https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html) に公表されている。特定臨床研究開始にあたり、研究責任医師は実施のための計画書(利益相反を含む)をこの委員会に提出して審査を受ける。委員会は実施基準への適合性を審査し、実施の適否・留意事項を指摘する義務がある。さらに、研究開始後も、疾病や副作用出現の報告および定期報告などについても評価を行い、研究責任医師に意見を述べる。
注2:重篤な有害事象発生時の対応
認定臨床研究審査委員会に連絡する。特に予期しない重篤なものは PMDA にも直接報告する。
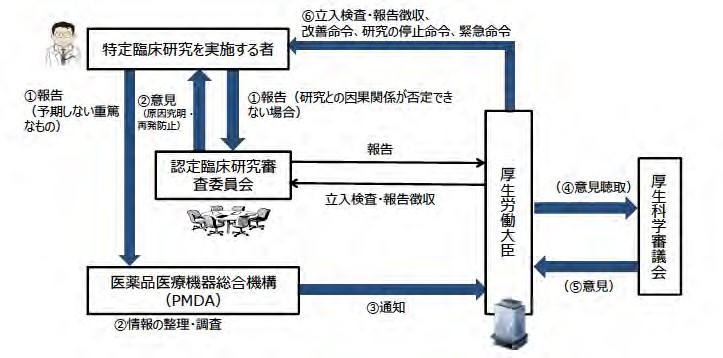
(厚生労働省 HP より引用)
報告までの期間
有害事象の内容により,報告までの期間が 7 日以内,15 日以内,30 日以内,認定臨床研究審査委員会への定期報告時,と定められている.詳細は https://www.mhlw.go.jp/content/10800000/000460132.pdf を参照
